作为年销售额过百亿美元,且仍在爆炸性增长的“超级重磅炸弹”,司美格鲁肽受到国内企业的争相竞逐。目前,华东医药、丽珠集团、宸安生物、联邦制药、齐鲁制药等的司美格鲁肽均步入了三期临床试验。随着2026年司美格鲁肽在国内的专利到期,国产司美格鲁肽有望迎来巨大的市场机遇。
在9月15日至9月21日的新发布周期内,通化金马的阿尔茨海默病新药三期临床达到主要临床试验终点,有望不久后进入申报上市阶段。此外,来自多禧生物、百济神州、中国生物等的10个创新药项目首次获批临床,我们将其纳入了“人民金融·创新药指数”。
受这些因素推动,新发布周期内,“人民金融·创新药指数”上涨了0.40%,最新报3818.49 点。
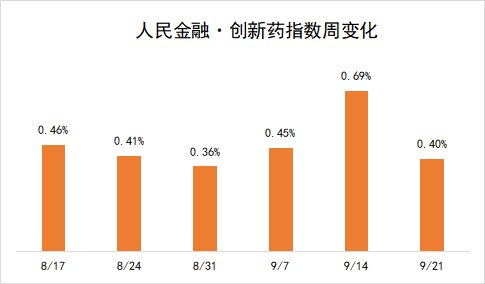
司美格鲁肽国内竞争白热化
9月20日,华东医药宣布,其长效胰高血糖素样肽-1受体激动剂司美格鲁肽注射液三期临床试验完成首例患者入组及给药。
无独有偶,药物临床试验登记与信息公示平台显示,9月18日石药集团的司美格鲁肽注射液也启动了临床试验,适应症是2型糖尿病。
此外,近期丽珠集团接受投资者调研时称,公司多年前就启动了司美格鲁肽的早期研发工作,去年下半年获批临床后,一直全力推进其临床试验相关工作,目前III期临床试验完成入组,预计2024年报产,争取2025年获批。
从这些进展来看,作为年销售额过百亿美元,且仍在爆炸性增长的超级重磅炸弹,司美格鲁肽受到国内企业的争相竞逐。根据公开资料,除了华东医药和丽珠集团,宸安生物、联邦制药、齐鲁制药等的司美格鲁肽也在开展III期临床试验,随着临床进度的不断推进,司美格鲁肽的竞争格局无疑会白热化。
目前,国内药企的司美格鲁肽正在开展的临床试验均为糖尿病适应症,市场对其更为期待的是减重适应症。其中,联邦制药和华东医药正在或计划在国内启动用于肥胖或超重适应症的临床试验,丽珠集团也表示“下一步考虑减肥适应症”。
值得关注的是,司美格鲁肽在国内的专利将于2026年到期,届时司美格鲁肽的类似药上市将面临巨大的市场机遇,国产药物有望和“减肥神药”一同在减肥的千亿蓝海赛道竞争。
不过,在司美格鲁肽作为减重药物受到热捧的同时,其用药安全性也不容忽视。据报道,司美格鲁肽常见的不良反应有头晕头痛、呕吐、腹痛等胃肠道反应,胃病患者不适合使用,容易导致食道反流等;偶尔发生的不良反应有过敏、心跳加快、血压下降、味觉障碍等。FDA 黑框警告甲状腺髓样癌个人既往病史或家族病史,或2型多发性内分泌肿瘤综合征患者禁用。此外,司美格鲁肽可能会增加胰腺炎、胆石症、糖尿病性视网膜病的发病风险,此类不良反应的高风险人群应慎用。另外,节食很容易导致人营养不良,随之而来的就是抵抗力下降,甚至免疫系统都会受到影响。
因此,为了争夺更大的市场空间,后来者可以在减重效果和安全性上做文章,打败司美格鲁肽。
据报道,目前诺和诺德的CagriSema已经开启了与司美格鲁肽的头对头试验,这是一种由Cagrilintide和司美格鲁肽组成的组合疗法;礼来的双靶点GLP-1类药物替尔泊肽紧随其后,于今年4月开启了头对头司美格鲁肽的减重临床试验。未来,或有更多候选药物正面硬刚司美格鲁肽,减重药王争夺战已开启。
此外,当前处于临床阶段的GLP-1药物多为单靶点,而针对GLP-1R、GIPR、GCGR 等靶点的双重/三重激动剂在临床上表现出了赶超前代药物的突出疗效,正逐渐成为开发重点。
在全球GLP-1类多靶点“减重”药物中,除了礼来的替尔泊肽,信达生物/礼来的Mazdutide也已经进入了Ⅲ期临床试验。此外,国内药企豪森制药、华东医药、鸿运华宁、硕迪生物也在针对该双靶点布局,但均处于研发早期阶段。
在GLP-1类三靶点激动剂布局中,礼来的Retatrutide进度最快,据礼来披露,计划于今年启动Ⅲ期临床试验。除此之外,还有诺和诺德、赛诺菲的三靶点激动剂“减重”适应症进入一期临床试验。国内方面,华东医药控股子公司浙江道尔生物的全球首创新药DR10624在新西兰已经进入Ⅰ期临床试验,在国内尚处于临床前研究阶段。
通化金马阿尔茨海默病新药三期研究成功
9月20日,通化金马药业发布公告,旗下1类新药琥珀八氢氨吖啶片用于治疗轻、中度阿尔茨海默病的III期临床试验已完成揭盲和主要数据的统计分析,达到主要终点。
琥珀八氢氨吖啶片是一种新的乙酰胆碱酯酶抑制剂,具有双重胆碱酯酶抑制功能,可以同时抑制乙酰胆碱酯酶和丁酰胆碱酯酶。体外试验表明,琥珀八氢氨吖啶片对乙、丁两种胆碱酯酶的抑制能力分别是常规一线用药的数倍,故有更好的临床治疗效果,同时I期、II期临床也验证了其临床效果;并且,琥珀八氢氨吖啶片的安全性相对更可靠、更安全。
本次III期临床试验结果显示,琥珀八氢氨吖啶片对AD评定量表认知部分的改善具有明显的临床意义;在安全性上,治疗组不良事件及不良反应的发生率均低于两个对照组。与安慰剂组比较,结果具有显著的统计学意义。
通化金马表示,琥珀八氢氨吖啶片III期临床试验揭盲后,将进入统计报告、临床研究总结报告及新药注册申请资料撰写阶段。这意味着,该药有望不久后进入申报上市阶段。
10个创新药项目首次获批临床
在新发布周期内,来自多禧生物、百济神州、中国生物等的10个创新药项目首次获批临床,我们将其纳入了“人民金融·创新药指数”。
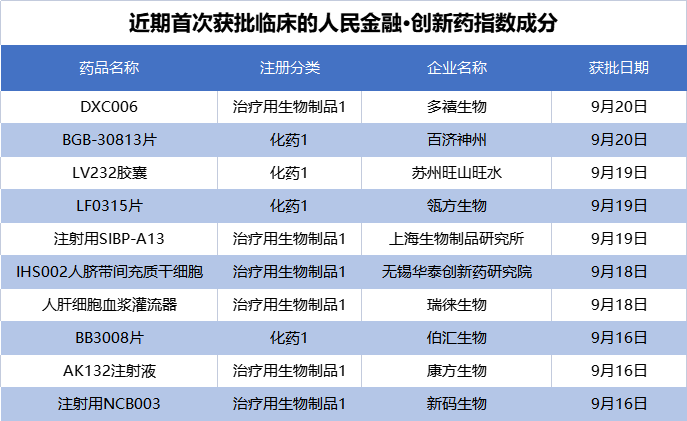
其中,多禧生物的DXC006是一款ADC药物于9月20日获批临床,将开展多种实体瘤、血液瘤的临床研究。据悉,多禧生物是国内ADC产品布局最多的企业之一,拥有30余条处于不同研发阶段的ADC药物,DXC006为其第8款申报临床的ADC药物。
百济神州的BGB-30813片也于9月20日获批临床。据报道,BGB-30813是国内首款申报临床的国产DGKζ抑制剂,BGB-30813具有增强DAG下游信号通路的潜力,可以激活T细胞,从而增强肿瘤杀伤作用。目前,全球范围内在研的DGKζ抑制剂仅有安斯泰来的ASP1570和拜耳的BAY 2965501。
9月19日,国药集团中国生物上海生物制品研究所的注射用SIBP-A13获批临床,拟用于在晚期恶性实体瘤患者中开展临床试验。据中国生物官微,SIBP-A13是上海生物制品研究所基于国内领先的第3代ADC技术研发的靶向HER3 ADC新药,具有连接子可裂解、载荷活性强、抗肿瘤“旁观者效应”等药物优势。
此外,苏州旺山旺水的抗抑郁药物LV232胶囊、康方生物的CD47/CLDN-18.2双抗AK132注射液、新码生物的新一代定点偶联长效人白介素-2药物注射用NCB003等创新品种也于近日获批临床,这些新成分的纳入是推动“人民金融·创新药指数”走高的主要原因。




